Je rédige cet article en réponse à ceux qui se demandent si les AMM conditionnelles ont bien été renouvelées, en complément de l’article que j’ai rédigé en mars 2021. Ainsi, je vous récapitule ici les liens vers les éléments officiels publiés sur le site de l’agence européenne du médicament.
Je précise que je fais ce travail à titre purement bénévole, et que je n’ai aucun conflit d’intérêt avec l’industrie pharmaceutique.
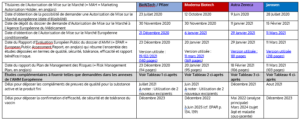
Les AMM conditionnelles de Pfizer et Moderna ont donc bien été renouvelées respectivement les 15 novembre et 29 Octobre 2021. Vous trouverez les liens vers les rapports d’évaluation des demandes de renouvellement d’AMM conditionnelles (EPAR Assesment Report) ici :
Pour Pfizer : EPAR Publié le 15/11/2021 – EMA/596333/2021
Pour Moderna : EPAR Publié le 29/10/2021 – EMA/571969/2021
Les notices scientifiques complètes en français se trouvent ici :
L’historique complet des produits est publié ici :
Si vous voulez approfondir un sujet particulier dans les données des laboratoires transmises officiellement toujours par l’EMA, vous pouvez aller consulter le détail dans le Plan de management des risques en ce qui concerne le risque lié au produit :
Par exemple, on trouve page 99 du RMP de Pfizer la section “Informations manquantes : Utilisation pendant la grossesse et l’allaitement – impact bénéfice-risque”:
Le profil de sécurité du vaccin n’est pas connu chez les femmes enceintes ou allaitantes en raison de leur exclusion initiale de l’étude clinique pivot, cependant une étude clinique sur la sécurité et l’immunogénicité du vaccin COVID-19 chez les femmes enceintes est en cours (C4591015) ; et 2 études non interventionnelles (C4591009 et C4591011). Ces études continuent jusqu’à mi 2023 (cf tableaux pages 126).
Texte d’origine en anglais :
“The safety profile of the vaccine is not known in pregnant or breastfeeding women due to their initial exclusion from the pivotal clinical study, however one clinical study of the safety and immunogenicity of the COVID-19 vaccine in pregnant women is ongoing (C4591015); and 2 non-interventional studies (C4591009 and C4591011) to assess whether sub-cohorts of interest, such as pregnant women, experience increased risk of safety events of interest following receipt of the COVID-19 vaccine are approved.
It is important to obtain long term follow-up on women who were pregnant at or around the time of vaccination so that any potential negative consequences to the pregnancy can be assessed and weighed against the effects of maternal COVID-19 on the pregnancy.”
Page 110 Présennetation des informations manquantes sur la grossesse et l’alaitement
SVII.3.2. Presentation of the Missing Information
Table 52. Use in Pregnancy and while Breast Feeding
Evidence source:
The safety profile of the vaccine is not known in pregnant or breastfeeding women due to their initial exclusion from the pivotal clinical study. There may be pregnant women who choose to be vaccinated despite the lack of safety data. It will be important to follow these women for pregnancy and birth outcomes.
The timing of vaccination in a pregnant woman and the subsequent immune response may have varying favourable or unfavourable impacts on the embryo/foetus. The clinical consequences of SARS-CoV-2 infection to the woman and foetus during pregnancy is not yet fully understood and the pregnant woman’s baseline health status may affect both the clinical course of her pregnancy and the severity of COVID-19.
These factors and the extent to which the pregnant woman may be at risk of exposure to SARS-CoV-2 will influence the benefit risk considerations for use of the vaccine.
Population in need of further characterization:
The lack of data is communicated in product labelling; for clinical study of the safety and immunogenicity of COVID-19 mRNA vaccine in pregnant women and while breast feeding.
Page 121 : Le titulaire de l’AMM (Pfizer) convient qu’il est essentiel de surveiller la sécurité des vaccins chez les femmes enceintes.
The MAH (Pfizer) agrees that monitoring vaccine safety in pregnant women is critical. Given that a pregnancy registry based on primary data collection is susceptible to non-participation, attrition, small sample size and limited or lack of comparator data, Pfizer, on behalf of the MAH, would like to propose monitoring vaccine safety in pregnancy using electronic health care data, which could be conducted in a representative pregnant woman population exposed to the vaccine and minimize selection bias, follow-up bias, and reporting bias. In addition, internal comparison groups, such as contemporaneous unvaccinated pregnant women or women receiving other vaccine(s) to prevent COVID-19 (if available) could be included.
Faites vos traductions avec votre navigateur ou les logiciels de traduction à disposition.